НОБЕЛЕВСКАЯ ПРЕМИЯ ПО ХИМИИ 2010 года
| Статьи и публикации |
 НОБЕЛЕВСКАЯ ПРЕМИЯ 2010 года отметила достижение в области органической химии, которое вызвало прорыв в химической промышленности, предоставив универсальный инструмент для создания уникальных соединений с заданной химической структурой.
НОБЕЛЕВСКАЯ ПРЕМИЯ 2010 года отметила достижение в области органической химии, которое вызвало прорыв в химической промышленности, предоставив универсальный инструмент для создания уникальных соединений с заданной химической структурой.
Современному человеку требуются все более и более сложные, изощрённые вещества - новые антибиотики, лекарства от рака, противовирусные средства, средства защиты растений, светоизлучающие молекулы для микроэлектроники.
Химию надо любить. Это очень красивая наука, описывающая процессы, происходящие в мире атомов и молекул. Химию надо уважать, поскольку созданные учёными химические соединения позволили человеку сотворить цивилизацию, такую непохожую на мир дикой природы. А чтобы понять, как устроен мир вокруг нас - одежда, строительные материалы, дороги, машины, компьютеры - химию нужно знать.
Чем более сложные вещества требовались человеку на пути прогресса, тем сложнее становились химические реакции, приводящие к их созданию. Сначала химики шли по пути проб и ошибок, затем они научились предсказывать ход реакций и создавать оптимальные условия для синтеза того или иного продукта.
Вот тогда появилась возможность синтезировать сложные вещества с необычными и полезными свойствами. Большая часть их представляет собой органические соединения.
Все живые организмы состоят из органических соединений. Так устроено в природе, что «молекулярный скелет» абсолютно всех органических молекул - это более или менее сложная цепочка соединенных между собой атомов углерода. Связь углерод-углерод, пожалуй, самая важная химическая связь для всего живого на земле.
Атом углерода, как и все прочие атомы, представляет собой положительно заряженное ядро, окружённое слоями электронных облаков. Но для химиков представляет интерес только внешний слой, потому что именно с наружными облаками обычно случаются превращения, которые и называются химическими реакциями. В процессе химической реакции атом стремится достроить свой внешний электронный слой так, чтобы вокруг ядра «крутились» восемь электронов. Сам по себе атом углерода имеет только четыре внешних электрона, поэтому в химической связи с другими атомами он стремится обобществить четыре «чужих» облака, чтобы достичь заветной стабильной «восьмёрки». Так, в простейшей органической молекуле - метане - атом углерода совместно «владеет» электронами с четырьмя атомами водорода.
А теперь представим, что нам надо синтезировать очень сложную органическую молекулу, похожую на ту, которая встречается в природе. Природные вещества зачастую обладают полезными свойствами - излучают свет, оказывают противоопухолевое, антибактериальное, обезболивающее воздействие, полимеризуются. И наладить их лабораторный синтез - задача очень заманчивая. Белковые молекулы синтезируют методами генетической инженерии, а вот небелковые приходится «варить» вручную в химической лаборатории, что не так уж и просто. Несколько маленьких органических молекул служат строительными блоками будущей сложной природной конструкции. Как заставить их провзаимодействовать между собой? Ведь атом углерода в органической молекуле стабилен и ни в какие реакции с другими атомами вступать не намерен.
«Расшевелить» атом углерода, сделать его реакционноспособным - задача поистине нобелевская. В начале века Виктор Гриньяр (Victor Grignard), нобелевский лауреат 1912 года, впервые нашёл способ сделать углерод активнее - он связал его с атомом магния, в результате чего углерод потерял стабильность и «занялся поисками» другого атома углерода для образования с ним химической связи. А всего за всё время существования Нобелевских премий, пять премий по химии присуждены за разработку методов синтеза, приводящих к созданию связи между двумя атомами углерода. Помимо Гриньяра премии за решение этой важной задачи удостоились Отто Дильс (Otto Diels) и Курт Альдер (Kurt Alder) (1950), Герберт Браун (Herbert C. Brown) и Георг Виттиг (Georg Wittig) (1979), Ив Шовен (Yves Chauvin), Роберт Груббс (Robert H. Grubbs) и Ричард Шрок (Richard R. Schrock) (2005).
Лауреаты НОБЕЛЕВСКОЙ ПРЕМИИ ПО ХИМИИ
И, наконец, НОБЕЛЕВСКАЯ ПРЕМИЯ по химии 2010 года также присуждена за новый метод создания углерод-углеродной связи.
Нобелевский комитет присудил премию Ричарду Хеку (Richard F. Heck), Ей-ичи Негиши (Ei-ichi Negishi) и Акира Сузуки (Akira Suzuki) «за применение реакций кросс-сочетания с использованием палладиевых катализаторов в органическом синтезе».
Реакциями кросс-сочетания называют такие органические реакции, в ходе которых химическая связь образуется между двумя атомами углерода, находящимися в составе разных молекул.
До начала «эры палладия», которую открыли работы нынешних лауреатов, химикам-органикам приходилось синтезировать сложные молекулы из блоков в несколько стадий. За счёт высокой активности реагентов в реакциях образовывалось такое количество побочных соединений, что выход конечного продукта оказывался мизерным. Использование палладия стало очень удачным выходом из положения. Он оказался идеальным «местом встречи» атомов углерода. На атоме палладия два атома углерода располагаются так близко друг к другу, что между ними может начаться взаимодействие. Реакция на палладии протекает с высоким выходом нужного продукта без нежелательных побочных процессов.
Нобелевские лауреаты по химии нынешнего года разработали методики для двух типов реакций с участием палладия. В обеих реакциях взаимодействуют два реагента - электрофильный (с дефицитом электронной плотности) и нуклеофильный (с избытком электронной плотности). В качестве электрофильного агента всегда выступает молекула углеводорода, в котором концевой атом водорода замещён на атом галогена (хлор, бром, йод). А вот нуклеофильные агенты различаются - в одном случае используется молекула олефина (линейного углеводорода с одной двойной связью), а в другом - металлоорганическое соединение (цинк, бор или олово). Сначала образуется комплекс атома палладия с электрофильным агентом, а затем этот комплекс взаимодействует с нуклеофильным соединением.
Сама идея использования переходных металлов, и палладия в том числе, в органическом синтезе возникла задолго до работ нынешних нобелевских лауреатов. В 1950-е годы в Германии впервые палладиевый катализатор стал использоваться для промышленного окисления этилена в ацетальдегид (Вакер-процесс) - важное сырьё для производства красок, пластификаторов и уксусной кислоты.
В то время Ричард Хек работал в химической компании в Делавэре. Он заинтересовался Вакер-процессом и начал эксперименты с использованием палладия. В 1968 году Хек опубликовал серию научных статей по металлоорганическому синтезу c применением олефинов. Среди них - новый способ «сшивания» молекулы простого олефина с бензольным кольцом. Продукт такой реакции - винилбензол, из которого получают пластик полистирол.
Через четыре года он развил новый метод с использованием олефинов, который сегодня называют реакцией Хека. Именно за это достижение ему присуждена Нобелевская премия. Новшество заключалось не только в олефинах, но также в использовании в качестве электрофильных агентов соединений углеводородов с галогенами.
С помощью реакции Хека сегодня получают: противовоспалительный препарат напроксен (Naproxen), лекарство от астмы - сингуляр (Singulair), светоизлучающие соединения для микроэлектроники, таксол (Taxol) - распространённый препарат для химиотерапии. Не очень тривиальным путём - в несколько стадий - по этой методике удаётся получить природный наркотик морфин и его химические модификации. Реакция Хека также используется для синтеза стероидных гормонов (половые гормоны, гормоны коры надпочечников) и стрихнина.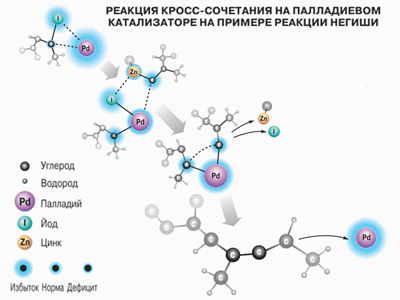
В 1977 году Ей-ичи Негиши вместо олефинов впервые применил в качестве нуклеофильного агента соединение с цинком. Такие реагенты не дают ненужные побочные продукты, выход конечного продукта получается очень высоким. Реакция Негиши позволила химикам «сшивать» между собой сложные функциональные группы, которые «по Хеку» синтезировать было невозможно.
Два года спустя Акира Сузуки впервые использовал в качестве нуклеофила соединение, содержащее атом бора. Стабильность, высокая селективность и низкая химическая активность органических соединений бора сделали реакцию Сузуки одной из самых полезных с точки зрения практического применения в промышленном производстве. Соединения бора малотоксичны, реакции с их участием идут в мягких условиях. Всё это особенно ценно, когда дело касается производства десятков тонн продукта, например фунгицида боскалид (Boscalid), - средства защиты сельскохозяйственных культур от грибковых заболеваний.
Одно из впечатляющих достижений метода Сузуки - синтез в 1994 году палатоксина, природного яда, содержащегося в гавайских кораллах. Палатоксин состоит из 129 атомов углерода, 223 атомов водорода, 3 атомов азота и 54 атомов кислорода. Синтез такой огромной органической молекулы вдохновил химиков на другие подвиги. Реакция Сузуки стала мощным инструментом химии природных соединений. Ведь только синтезировав искусственный аналог в пробирке и сравнив его свойства с природным веществом, можно достоверно подтвердить химическую структуру того или иного природного соединения.
Перспективы открытия нобелевских лауреатов
Сейчас взоры химиков-органиков в большой степени обращены в сторону Мирового океана, который можно рассматривать как склад фармацевтической продукции. Морские обитатели, а вернее, физиологически активные вещества, которые они выделяют, сегодня служат основным источником прогресса в создании новых лекарств. И в этом учёным помогают реакции Негиши и Сузуки.
Так, химикам удалось синтезировать дазонамид А из филиппинской асцидии, который хорошо себя показал в борьбе с раком кишечника. Синтетический аналог драгмацидина F из морской губки с итальянского побережья поражает ВИЧ и герпес. Дискодермолид из морской губки Карибского моря, который синтезируют с помощью реакции Негиши, по функциональной активности очень похож на таксол.
Палладиевые катализаторы помогают не только синтезировать природные соединения в лабораторных условиях, но и модифицировать существующие препараты. Так произошло с ванкомицином - антибиотиком, который с середины прошлого века применяется для лечения золотистого стафилококка. За время, прошедшее с начала использования препарата, бактерии приобрели к нему устойчивость. Так что теперь приходится с помощью палладиевого катализа синтезировать всё новые и новые химические модификации ванкомицина, которым «по плечу» даже устойчивые бактериальные особи.
Органические молекулы, способные испускать свет, используются в производстве светодиодов. Синтезируются такие сложные молекулы также с помощью реакции Негиши и Сузуки. Химическая модификация светоизлучающих молекул даёт возможность повысить интенсивность голубого свечения под действием электрического тока. Органические светоизлучающие диоды (OLED) используются в производстве супертонких, толщиной всего лишь несколько миллиметров, дисплеев. Такие дисплеи уже применяются в мобильных телефонах, GPS-навигаторах, в приборах ночного видения.
Синтез с помощью палладиевого катализатора применяется в фармацевтической промышленности, производстве средств защиты растений, высокотехнологичных материалов. С помощью реакций кросс-сочетания можно создать аналоги природных соединений практически любой молекулярной конфигурации, что очень важно для понимания взаимосвязи между структурой и свойствами сложных органических молекул.
Реакции Хека, Сузуки и Негиши постоянно видоизменяются и дополняются другими химиками. Одно из таких новшеств связано с Нобелевской премией по физике нынешнего года. Учёным удалось прикрепить атомы палладия к молекулярной решётке графена, полученный катализатор на твёрдом носителе с успехом использовался для проведения реакции Сузуки в водной среде. Практическое использование графена - дело будущего, а реакции кросс-сочетания на палладиевом катализаторе уже сослужили человечеству великую службу, хотя на самом деле их триумфальное шествие только начинается.



